|
红外体温计出口通关要求及部分国家(地区)主要技术性贸易措施提示如下:
一、出口通关要求
红外体温计根据其是否与人体表面接触分为接触式红外体温计(耳温枪)、非接触式红外体温计(额温枪)两种。

二、禁限管理
自4月1日起,出口新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计的企业向海关报关时,须提供书面或电子声明,承诺出口产品已取得我国医疗器械产品注册证书,符合进口国(地区)的质量标准要求。
海关凭药品监督管理部门批准的医疗器械产品注册证书验放。上述医疗物资出口质量监管措施将视疫情发展情况动态调整。

国家药监局官网医疗器械产品注册信息查询地址(动态更新):http://www.nmpa.gov.cn/WS04/CL2582/
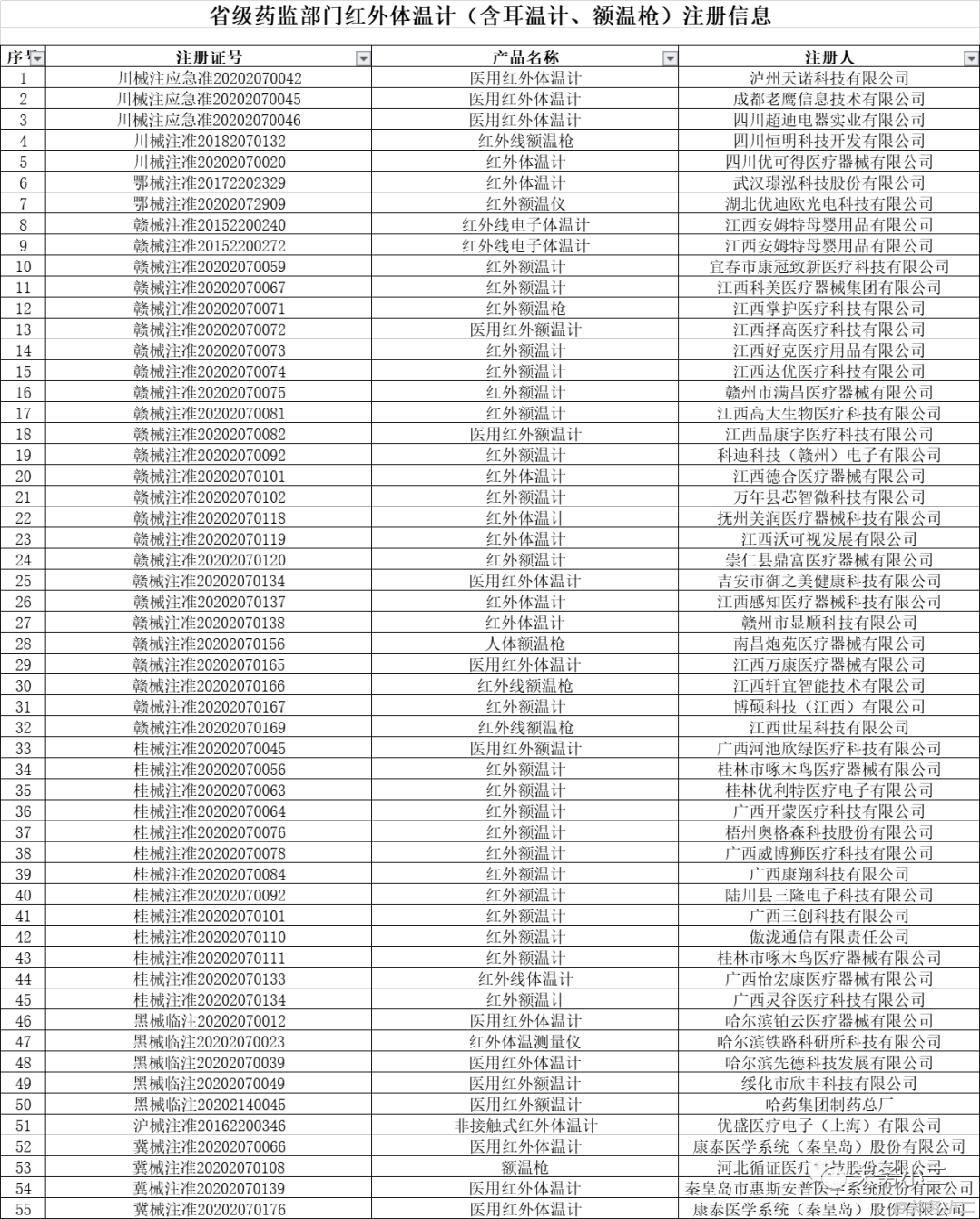
(具有红外体温计出口资质的部分企业名单)
三、退税管理
四、各国红外体温计的准入条件
美国
医疗器械进入美国市场可按照豁免、510(k)、PMA三种情况申请。常见的红外体温计在美国FDA属于II类医疗器械,需要按照510(k)来申请,510(k)申请流程: 1.进行产品测试(性能测试、生物学测试) 2.准备510(k)技术文件,提交FDA审评 3.获得FDA的510(k)批准信 4.完成工厂注册和器械列名
510(k)文件是企业向FDA递交的产品上市前申请文件,目的是证明所申请上市的产品和已在美国市场上合法销售的产品在安全性和有效性方面比较是实质相等的,即为等价器械(substantially equivalent)。申请者必须把申请上市的器械与现在美国市场上一种或多种相似器械进行对比,得出支持等价器械的结论。对FDA 510(k)注册文件所必须包含的信息,FDA有一个基本的要求,其内容大致如下16个方面:
1.申请函。此部分应包括申请人(或联系人)和企业的基本信息、FDA 510(k)递交的目的、申请上市器械的名称型号和分类资料、进行实质等效比较的产品(Predicate Device)名称及其510(k)号码。 2.目录。即FDA 510(k)文件中所含全部资料的清单(包括附件)。 3.真实性保证声明。FDA有一个标准的样本。 4.器材名称。即产品通用名、FDA分类名、产品贸易名。 5.注册号码。如企业在递交FDA 510(k)时已进行企业注册,则应给出注册信息,若未注册,也予注明。 6.分类。即产品的分类组、类别、管理号和产品代码。 7.性能标准。产品所满足的强制性标准或自愿性标准。 8.产品标识。包括企业包装标识、使用说明书、包装附件、产品标示等。 9.实质相等性比较(SE)。选择合适的产品进行比较是510(k)申请的关键步骤。在进行比较时应从如下方面进行考虑:企业必须提供充足的资料证明,所申请上市的器械和被比较的器械是实质相等的(SE),否则510(k)申请不会通过。 10.510(k)摘要或声明。申请文件摘要和支持等价器械的结论。 11.产品描述。包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等。 12.产品的安全性与有效性。包括各种设计、测试资料。 13.生物相容性。生物相容性是指材料与生物体之间相互作用后产生的各种生物、物理、化学等反应的一种概念。一般地讲,就是材料植入人体后与人体相容程度,也就是说是否会对人体组织造成毒害作用。 14.色素添加剂(如适用)。 15.软件验证(如适用)。 16.灭菌(如适用)。包括灭菌方法的描述、灭菌验证产品包装和标识等。
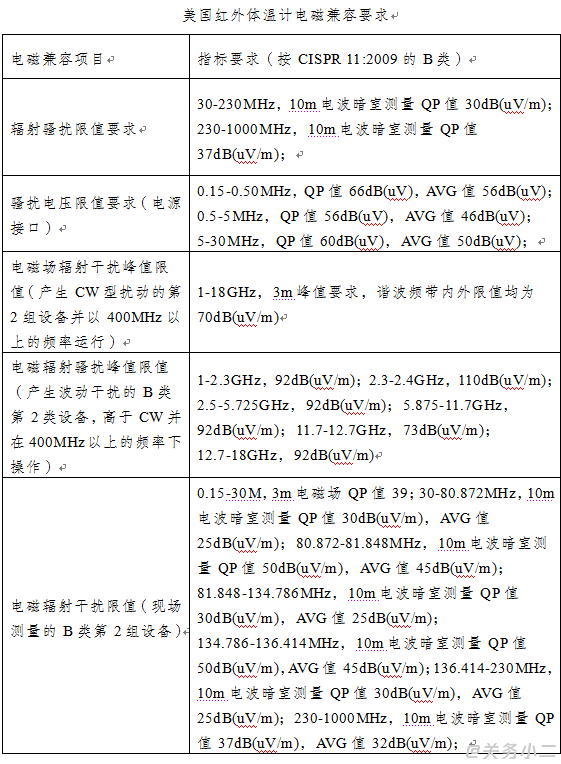
美国的红外体温计相关检测标准包括: ANSI/AAMI ES60601-1:2005/(R)2012,(IEC 60601-1:2005,MOD)《医用电气设备第1部分:基本安全和基本性能的通用要求》,ANSI/AAMI/IEC 60601-1-2:2014《医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验》,ANSI/AAMI HA 60601-1-11:2015 (IEC 60601-1-11:2015,MOD)《医用电气设备第1-11部分:基本安全和基本性能的通用要求.并列标准:医用电气设备和家庭医疗保健环境中使用的医用电气系统的要求》,ASTM E 1965-98:2016《间歇测定病人体温用的红外温度计》。按检测类型分为基本要求、电磁兼容要求和性能要求。
技术标准简析: 美国红外体温计涉及的项目包括输入功率;保护接地、功能接地和电位均衡;电介质强度;抗跌落性;电磁兼容等。项目要求如下: 

欧盟
欧盟将医疗器械划分为三大类,I类(包含I和I*)、II类(包含IIa和IIb)及III类。无论属于哪一类,出口欧盟都需要申请CE认证。
红外体温计属于II类医疗器械,II类以上产品需要欧盟公告机构参与,如TUV南德、TUV莱茵、BSI、DNV、SGS等。企业需要先完成CE认证文件并提交通过审核后方进行体系审核,最终拿到CE和符合欧盟标准的体系证书。
红外体温计的CE认证需要满足欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)。
红外体温计的CE认证程序如下: 1.企业向认证机构提出认证申请并填写认证询价单交认证机构。 2.认证机构向申请认证企业提出报价单,企业签字确认即完成合约。 3.企业向认证机构提交ISO9000+ISO13485质量体系文件即质量手册和程序文件,供认证机构进行体系文件审核;质量体系审核前,企业应至少三个月的质量体系运行记录,并完成1-2次内部质量体系审核。 4.认证机构发出认证产品测试通知单给认证机构认可的实验室,由实验室对申请认证的产品进行测试。测试合格后,实验室出具试验报告。相关的检测标准如下: EN 60601-1:2006+A1:2013《医用电气设备第1部分:基本安全和基本性能的通用要求》 EN 60601-1-2:2015《医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验》 EN 60601-1-11:2015《医疗电气设备 第1-11部分:基本安全和基本性能的一般要求 并行标准:家用医疗保健环境使用的医疗电气设备和医疗电气系统的要求》 ISO80601-2-56:2017《医用电气设备 第2-56 部分:体温测量的临床体温计基本安全和基本性能的特殊要求》 5.制造商必须根据产品所符合指令的要求及风险评估的需要,建立产品的技术文件(TCF)。如果相关授权部门要求,制造商须将技术文件及EC符合性声明一起提交检查。 6.认证机构对企业的ISO9000+ISO13485质量体系和TCF文件进行审核。 7.正式审核通过后,认证机构将于企业签订框架协议,明确各方应遵循原则和CE标志的范围等。
建议企业找欧盟认可的公告机构进行检测: 1.欧盟官网MDD 93/42/EEC医疗器械指令授权的机构查询地址: https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13 2.欧盟官网MDR (EU) 2017/745医疗器械法规授权的机构查询地址: https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
技术标准简析: 欧盟和美国标准基本要求都采标自国际标准IEC 60601-1:2005(欧盟标准采标自IEC 60601-1:2005+A1:2012),IEC 60601-1-11:2015;电磁兼容要求都采标自国际标准IEC 60601-1-2:2014。故基本要求和电磁兼容要求无大差异,详见之前美国技术标准解析,但欧盟性能标准与美国有差异。
欧盟红外体温计性能要求:
日本
如是需要投放市场产品,必须满足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,TOROKU注册系统要求国外的制造商必须向日本医药品和医疗器械综合机构(PMDA)注册制造商信息。
韩国
韩国卫生福利部(Ministry of Health and Welfare),简称卫生部MHW,主要负责管食品、药品、化妆品和医疗器械的管理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。KFDA注册流程为:
1.确定产品分类(I,II,III,IV),选择KLH(韩国持证方)。 2.II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书。 3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试。 4.由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批。 5.支付申请费用。 6.注册文件整改,注册批准。 7.指定韩国代理商和经销商,产品销售。涉及标准有: KS C ISO 80601-2-56:2012《医用电气设备 第2-56 部分:体温测量的临床体温计基本安全和基本性能的特殊要求》 KS C IEC 60601-1:2011 《医用电气设备第1部分:基本安全和基本性能的通用要求》 KS C IEC 60601-1-2:2012《医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验》 KS C IEC 60601-1-11:2012《医疗电气设备.第1-11部分:基本安全和基本性能的一般要求.并行标准:家用医疗保健环境使用的医疗电气设备和医疗电气系统的要求》 KS ISO 10993-5:1999《医疗器械生物学评估-第5部分:体外细胞毒性试验》 KS ISO10993-10:2002《医疗器械生物学评估-第10部分:刺激性和延迟过敏反应试验》
澳大利亚
在澳大利亚,医疗器械是指用于人体的仪器、设备、器具、材料或者其他物品(单独或者组合使用及适当应用所需的软件),用以实现诊断、预防、监护、治疗或缓解疾病的目的。
在澳大利亚生产医疗器械产品,必须通过合格性评定,评定医疗器械是否符合在相关国家市场(如澳大利亚、欧洲及美国)上市的标准要求;销售医疗器械则必须在器械电子申请报关系统(DEAL)进行在线申请,完成在澳大利亚治疗品注册处(ARTG)的产品注册。ARTG是注册处的一个治疗产品备案制度,要求经销商对所生产和经营(包括进出口)的医疗器械产品负责。
在澳大利亚生产经营医疗器械产品,本土生产商需获得治疗品管理局颁发的合格评定证书;海外生产商则需要具备互认协议证书/欧洲CE认证和澳大利亚的合格声明。生产商将合适的合格评定证书交给经销商,再由经销商通过DEAL系统进行提交作为生产商资质的证明。TGA审评后将通过生产商的资质证明申请。经销商通过DEAL系统提交医疗器械申请并缴纳一定申请费用,TGA会把该医疗器械添加到ARTG备案中。经销商必须缴纳年费,TGA需对产品进行上市后的监测。
海外生产商需具备互认协议证书/欧洲CE认证和澳大利亚的合格声明。
五、各国红外体温计技术标准简析
各国家(地区)关于红外体温计等医疗器械相关的技术标准为各国家(地区)进口或销售时,由其海关或相关部门要求验核;如有动态调整,请以相关标准管理机构官方发布为准。
来源:广州海关、12360海关热线,部分内容有调整。
更多防疫物资出口申报指引:https://www.guanwuxiaoer.com/thread-892-1-1.html
| 
 /1
/1 
![]() 粤公网安备44030802000522号
粤公网安备44030802000522号